【効能・効果】
悪性神経膠腫の腫瘍摘出術中における腫瘍組織の可視化
【用法・用量】
通常、成人には、アミノレブリン酸塩酸塩として20mg/kgを、手術時の麻酔導入3時間(範囲:2~4時間)に、水に溶解して経口投与する。
| レセプト電算処理システムコード | 622242101 |
| 薬価基準収載医薬品コード | 7290007X1031 |
| 統一商品コード | 864301015 |
| GS-1コード(調剤包装単位) | 04987864015059 |
| GS-1コード(販売包装単位) | 14987864301012 |
| GS-1コード(元梱包装単位) | 24987864301019 |
| HOTコード | 1224214020101 |
| JANコード | 4987864301015 |
| YJコード | 7290007X1031 |
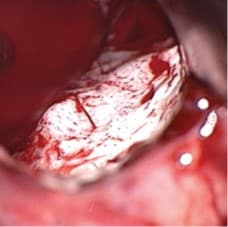
従来の照明下での観察

青色光下での観察
画像提供元:photonamic GmbH & Co. KG
※動画では海外での商品名である「Gliolan」または「Gleolan」が使用されていますが、日本での商品名は「アラベル®内用剤1.5g」です。
はい、76 kg以上の患者様には、2本お使いいただくこととなります。
用法・用量では20 mg/kg×80 kg=1600 mgとなります。1バイアルは1.5g(1500 mg)なので2バイアルを使用することになります。
麻酔導入前3時間(範囲:2~4時間)に服用の用法で承認を受けております。
【参考文献】
アラベル内用剤1.5g 電子添文 第3版 6. 用法及び用量
本剤は他剤および飲食物との配合試験を実施していません。また、本剤を水以外の溶液で溶解した場合の、有効性・安全性については検討していません。そのため、電子添文通り、本剤の溶解には「水」をご使用ください。
一方で、酸味があるため飲みにくいという理由で、オレンジジュースやブドウ糖液に溶解し、経口投与している報告もあります。1, 2)※
恐れ入りますが、最終的なご判断は各医療機関でお願い致します。
※文献2)は30 mg/kg又は60 mg/kgをオレンジジュース5~10 mLに溶解し経口投与していますが、承認された用法・用量と異なりますので注意して下さい。
【参考文献】
1) Regula et al., Gut. 1995; 36:67-75.
2) 梶本 他, 日本臨床 2010; 68-増刊号10: 375-382.
本剤1バイアルに注射用水50 mLを加えて溶解し、温度15~25℃、昼間散光下で24時間保存しました。
その結果、類縁物質、定量値、溶状(色及び澄明性)、pHに変化はなく安定でした。1)
そのため、溶解後は24時間以内にご使用いただくようお願いします。2)
24時間を過ぎた溶解液は廃棄してください。
【参考文献】
1) アラベル内用剤1.5g インタビューフォーム 第9版 8ページ目
2) アラベル内用剤1.5g電子添文 第3版 14. 適用上の注意 14.1.1
社内データではありますが、アラベル内用剤1.5gの酸味は100%レモン果汁に近いものでした。1)
【参考文献】
1) アラベル内用剤1.5g インタビューフォーム 第9版 62ページ目
食道粘膜に悪影響があるという報告はございません。
なお、アラベル内用剤1.5gを水に溶解した液のpH2.2~2.8で、胃酸のpHよりも高いため(胃酸のpHは1-2)1)、悪影響は出づらいと考えられます。
【参考文献】
1) 本郷, 化学と教育 2017; 65(7), 356-357.
経管投与での情報は持ち合わせておりません。
しかしながら本剤は水に溶けやすい薬剤ですので、電子添文に記載の通りにご調製いただきますと、完全に溶解し、チューブに詰まることは無いと考えられます。
【参考文献】
1) アラベル内用剤1.5g電子添文 第3版 6. 用法及び用量
有効成分であるアミノレブリン酸塩酸塩は、生物界に広く存在している生体内物質の5-アミノレブリン酸 (5-ALA)の塩酸塩であり、正常細胞ではプロトポルフィリンⅨ(PPⅨ:Protoporphyrin Ⅸ)を経て、最終的にヘムに変換されます。
腫瘍細胞では、正常細胞に比べてPPⅨからヘムに変換するための酵素活性が低いため、腫瘍細胞内では PPⅨが蓄積すると考えられています。また、この PPⅨは、青色光(400~410 nm)で励起されると赤色蛍光を発することが知られています。1)
【参考文献】
1) アラベル内用剤1.5g インタビューフォーム 第9版 1ページ目
偽陽性の原因として、炎症細胞の浸潤やグリオーシスを伴う領域に蛍光が認められることが考えられます。また、再発では治療等の影響によって血液脳関門が破綻し、5-ALAが大量流入することによる可能性も考えられます。1-3)
一方、偽陰性の原因として、腫瘍の壊死、蛍光物質であるPPIXの退色や非蛍光領域では正常細胞が多く存在することから、蛍光を感知できるほどの腫瘍細胞密度に達していなかった点が考えられます。1-3)
【参考文献】
1) アラベル内用剤1.5g 適正使用ガイド
2) アラベル内用剤1.5g CTD 5.3.5.2-1
3) アラベル内用剤1.5g 審査報告書 37-38ページ目
5-ALA塩酸塩投与後3-12時間は安定した赤色蛍光を発すると報告されております。1)
また、5-ALA塩酸塩投与後5-10時間範囲(術中にタイミングを分けて、最大3検体採取した。)で悪性神経膠腫の赤色の蛍光強度を観察して、7-8時間が蛍光強度のピークであったとの報告もございます。2)
なお、アラベル内用剤1.5gの用法は「手術時の麻酔導入前3時間(範囲:2~4時間)に水に溶解して経口投与する」で、先ほどご提示した報告は承認範囲外の用法が含まれることにご留意ください。3)
【参考情報】
<6症例のPPIXの血漿中濃度の平均値>
投与開始前: 1.7μg/ml、5-ALA投与後1時間: 22.3 μg/ml、2時間:85.9 μg/ml、3時間: 168.5 μg/ml、6時間:324.3 μg/ml、12時間: 223.7 μg/ml、24時間:16.8 μg/ml、48時間:2.4 μg/ml 4)
【参考文献】
1) 丸山隆志 他:日本臨牀 2005; 63(S9): 380-388.
2) Kaneko et al., Neurosurgery. 2019; 85(4):E739-E746.
3) アラベル内用剤1.5g 電子添文 第3版 6. 用法及び用量
4) アラベル内用剤1.5g インタビューフォーム 第9版 11ページ目
国内第Ⅲ相試験では、弱蛍光領域での生検組織ごとの陽性診断率(組織学的に腫瘍細胞が認められた率)は77.2%であり、浸潤している悪性腫瘍細胞と正常細胞が混在していると考えられます。1)
他の方法による診断や残すべき機能も踏まえて慎重に切除範囲をご検討ください。尚、腫瘍細胞が混在しているため、弱蛍光の箇所は出来るだけ除去した方が良いと主張される先生もいらっしゃいます。
【参考文献】
1) アラベル内用剤1.5g 適正使用ガイド 8ページ目
胃内pHの変動による本剤の効果に対する影響は検討していません。
光線過敏症は、顔面、項部、上胸部V領域、手背などの露光部位に限局して皮疹がみられます。1)
【参考文献】
1) 戸倉新樹:アレルギー・免疫 16(11):1756-1759, 2009
本剤の臨床薬理試験で皮膚光感作と血中PPIX濃度の関連性を検討した結果1)などから、投与後少なくとも48時間は強い光を避けることとしました。2)
臨床薬理試験1)において、海外の健康成人21例を対象に本剤20 mg/kgを経口投与して、本剤投与前と投与12時間、24時間および48時間後の皮膚の光感作を評価しました。
その結果、本剤投与24時間後までは光感作が認められ、投与48時間後では投与前の値に回復しました。
以上より、本剤投与後少なくとも48時間は、強い光(手術室の照明、直射日光又は明るい集中的な屋内光等)への眼及び皮膚の曝露を避け、照度500ルクス以下の室内で過ごさせる3)ようお願い致します。
【参考文献】
1) アラベル内用剤1.5g インタビューフォーム 第9版 13ページ目
2) アラベル内用剤1.5g インタビューフォーム 第9版 41-42枚目
3) アラベル内用剤1.5g電子添文 第3版 8. 重要な基本的注意 8.1
(1)
光線過敏症の発現を防ぐため、電子添文には、「本剤投与後少なくとも48時間は、強い光(手術室の照明、直射日光又は明るい屋内光等)への眼及び皮膚の曝露を避け、照度500ルクス以下の室内で過ごさせること」と記載しています。1)
病室の照度を出来る限り抑えるため、「カーテンやブラインドを閉める」、「ベッドは窓際を避けて配置する」、「患者さんの回りの照明をできるだけ落とす」などの対策をお願いします。また、病室から手術室を移動する間も強い光に当たらないようご注意ください。
(2)
本剤投与後少なくとも48時間は、強い光(手術室の照明、直射日光又は明るい集中的な屋内光等)への眼及び皮膚の曝露を避けること1)としています。
そのため、投与後48時間はテレビやパソコン、スマートフォンなど光を発する機器類の長時間の使用はできるだけ避けるようお願いします。
【参考文献】
1) アラベル内用剤1.5g 電子添文 第3版 8. 重要な基本的注意 8.1
(1)
光線過敏症の発現を避けるため、本剤投与後少なくとも48時間は、強い光(手術室の照明、直射日光又は明るい集中的な屋内光等)への眼及び皮膚の曝露を避けること1)としています。
手術中は患者さんの眼および皮膚に照度500ルクス以上の光が直接当たらないように、術野以外は布で覆うなどの対処をお願い致します。
(2)
術中に眼にライトを当てた場合の安全性について検討しておりません。
本剤は投与48時間後まで、強い光(手術室の照明、直射日光又は明るい集中的な屋内光等)への眼および皮膚への曝露を避け、照度500ルクス以下の室内で過ごす1)こととしています。
【参考文献】
1) アラベル内用剤1.5g 電子添文 第3版 8. 重要な基本的注意 8.1
国内第Ⅲ相試験で安全性を評価した45例中、副作用(臨床検査値異常を含む)発現例数は11例(24.4%)で、悪心3例(6.7%)、嘔吐2例(4.4%)でした。
【参考文献】
アラベル内用剤1.5g 適正使用ガイド 10ページ目
国内第Ⅲ相試験では、副作用は45例中、11例(24.4%)に認められ、肝機能異常は各2例(4.4%)でした。また、電子添文上では、肝機能障害は6.7%とあり、その内訳としてγ-GTP増加(6.7%)、AST増加(4.4%)、ALT増加(4.4%)、Al-P増加(2.2%)でした。
【参考文献】
アラベル内用剤1.5g 適正使用ガイド 10,12ページ目
副作用として低血圧は、国内臨床試験では報告されておりませんが、海外臨床試験6試験の中で562例中1例(0.2%)報告されております。なお、電子添文では、海外臨床試験でのみ報告された副作用は「発現頻度」不明として注意喚起しています。1)
【参考文献】
1) アラベル内用剤1.5g インタビューフォーム 第9版 46ページ目
心血管系疾患のある患者については、収縮期及び拡張期血圧、肺動脈圧並びに肺血管抵抗が低下するおそれがあると、電子添文の「9. 特定の背景を有する患者に関する注意 9.1.1」に記載しております。1), 2)
高血圧等の循環器系疾患の合併患者さんでは、重篤な低血圧が発現するおそれがありますので、慎重に本剤の投与をご検討ください。
また、悪性神経膠腫の腫瘍摘出術で、年齢の増加とRAS阻害剤の使用が5-ALAによる血圧低下作用を増強することが報告されております。3)
【参考文献】
1) アラベル内用剤1.5g 電子添文 第3版 9. 特定の背景を有する患者に関する注意
2) Herman et al. J Photochem Photobiol B. 1998; 43: 61-65
3) Morisawa et al., Photodiagnosis Photodyn Ther. 2022 :102657.
ICUの場合、500Lxを超える照度の可能性があるので、ICUでも500Lx以下の照度にお願い致します。施設担当者にご相談いただければと思います。これは病棟のベッドでも同じです。また、手術後、一定の時間は処置室で患者が過ごす施設もあるので、処置室でも注意が必要です。
保険適応の判断は、審査支払機関の先生方の判断に従う点にご留意ください。一方で、本剤の適応症は、「悪性神経膠腫の腫瘍摘出術中における腫瘍組織の可視化」ですので、本剤の投与前に、MRI検査等を実施した方がよいかもしれません。
2024年度の情報ですが、アラベル内用剤1.5gはDPC包括評価の対象薬剤です。DPC病院における診療報酬は「包括評価部分」+「出来高部分」で構成されております。「包括評価部分」につきましては、頭蓋内腫瘍摘出術+術中血管等描出撮影加算等(010010xx02x0xx 等)の点数が算定可能です。1)
また、「出来高部分」については、手術手技料として、 頭蓋内腫瘍摘出術 (K169) 等に加えて術中血管等抽出撮影加算(K939-2) 500点が追加で加算可能です。2)
【参考文献】
1) 厚生労働省 診断群分類(DPC)電子点数表(正式版)(令和6年5月21日更新)
https://www.mhlw.go.jp/content/12400000/001334365.xlsx
2) 厚生労働省 令和6年 厚生労働省告示第57号 別表第1
https://www.mhlw.go.jp/content/12404000/001251499.pdf
稀な遺伝性疾患で、2019年の全国調査では、47例と記載がございます。
【参考情報】
1) 難病情報センター ポルフィリン症 (指定難病254)
異なります。ICGの励起波長のピークは750~800 nm、蛍光波長のピークは805~845 nmと報告されております。1)
一方、5-アミノレブリン酸の代謝物であるプロトポルフィリンⅨ(PP Ⅸ)は青色光線(400~ 410 nm) により励起され赤色蛍光(635 nm付近)を発する性質を有しています。2)
【参考情報】
5-アミノレブリン酸の代謝物であるプロトポルフィリンⅨ(PP Ⅸ)は青色光線(400~ 410 nm) により励起され赤色蛍光(635 nm付近)を発する性質を有しています。2)
【参考文献】
1) 林, 画像電子学会誌, 2009 年 38 巻 3 号 p. 309-313.
2) アラベル内用剤1.5g インタビューフォーム 第9版 27ページ目
術中迅速病理診断が必要か否かについては、弊社よりお答えすることができません。
通常、悪性神経膠腫の診断はCTやPETなどの放射線力学的検査を行い、腫瘍の有無を推定致します。最終的には、病理判定で確定診断致します。1)
【参考文献】
1) 国立がん研究センターがん情報サービス
アラベル内用剤1.5gでは小児等を対象とした有効性及び安全性を指標とした臨床試験は実施していません。1)
適応外ですが、小児脳腫瘍に対して5-アミノレブリン酸(5-ALA)製剤を投与している報告が国内外でいくつかございます。2-7)
【参考文献】
1) アラベル内用剤1.5g電子添文 第3版 9.特定の背景を有する患者に関する注意 9.7小児等
2) 磯崎春菜ほか. 小児の脳神経. 2019:44 66-9.
3) Beez et al. Acta Neurochir(Wien). 2014 Mar;156(3):597-604.
4) Preuβ et al. Childs NervSyst. 2013 Aug;29(8):1263-7.
5) Skjøth-Rasmussen et al.Childs Nerv Syst. 2015 Nov;31(11):2173-7.
6) Barbagallo et al. Br J Neurosurg. 2014 Dec;28(6):750-4.
7) Ruge et al. J Neurosurg Pediatr. 2009 Nov;4(5):484-6.
弊社から送付できる資材は、総合製品情報概要、適正使用ガイドと添付文書です。
患者向けの冊子は作成しておりません。インタビューフォームの紙でのご用意はございません。
SBIファーマ株式会社 カスタマーセンター
電話番号:0800-170-7881
受付時間 9:00~17:00 (土、日、祝日および当社休日を除く)